식약처 국내 개발 코로나19 혈장분획치료제 2상 임상 승인
페이지 정보
작성자 작성일 20-08-23 18:03본문

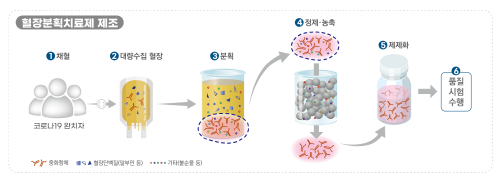
식품의약품안전처(이의경 처장)은 국내 개발 코로나19 혈장분획치료제 ‘GC5131’에 대하여 2상 임상시험을 8월 20일 승인하였다고 밝혔다.
이로써 현재 국내에서 코로나19 관련하여 진행 중인 치료제 및 백신의 임상시험은 총 16건(치료제 14건, 백신 2건)이 되었다.
이번에 승인한 ‘GC5131’은 ‘녹십자’에서 코로나19 완치자의 혈장을 이용해 개발 중인 ‘고면역글로불린(Hyper-immune Globulin)’ 성분 의약품으로, 코로나19 환자를 대상으로 안전성과 유효성을 평가하는 2상 임상시험을 진행하게 된다.
참고로 해외에서도 프랑스, 중국, 일본 및 이탈리아에서 혈장분획치료제를 개발 중이며, 현재 6개의 소규모 임상시험이 진행 중에 있다.
식약처는 코로나19 치료제·백신 개발에 대한 국민적 관심이 큰 만큼 앞으로도 국내 개발 제품의 임상시험 현황에 대해서 신속하게 정보를 전달하도록 하겠다고 밝혔다.김판용기자
- 이전글보건복지부 건강보험 거짓청구 요양기관 12개소 명단 공표 20.09.01
- 다음글동양하루살이 퇴치 위해 남한강 하천 지류에 미꾸리 치어 3만 마리 방류 20.08.19


